थॉमसन और रदरफोर्ड का परमाणु मॉडल|thomson and rutherford atomic model
आज हम physics के महत्वपूर्ण टॉपिक थॉमसन और रदरफोर्ड के परमाणु मॉडल (atomic model) के बारे में पढ़ने वाले हैं| परमाणु मॉडल के बारे में पढ़ने से पहले परमाणु क्या होता है? इसके बारे में थोड़ी सी जानकारी होना आवश्यक है| कुछ वैज्ञानिकों ने परमाणु के अलग-अलग परिभाषाएं दी है पहले हम उनको देखते हैं|
महर्षि कणाद के अनुसार-“ किसी द्रव्य का वह सूक्ष्मतम अदृश्य कण जिसे नष्ट नहीं किया जा सकता परमाणु कहलाता है|”
जॉन डाल्टन के अनुसार-“ किसी द्रव्य के सूक्ष्मतम कण को परमाणु कहते हैं |” प्रत्येक तत्व परमाणु से मिलकर बना होता है| परमाणु किसी भी तत्व की सूक्ष्मतम इकाई है जो किसी रासायनिक अभिक्रिया में भाग लेते हैं लेकिन प्रकृति में मुक्त अवस्था में नहीं पाए जाते हैं |
इलेक्ट्रॉन की खोज:सन् 1897 में ब्रिटिश भौतिकविद् जे.जे.थॉमसन ने विद्युत विसर्जन द्वारा विभिन्न तत्वों के परमाणुओं में उपस्थित ऋण आवेशित कण इलेक्ट्रॉन की खोज की|
थॉमसन का परमाणु मॉडल( Thomson's model of an atom)
सन् 1898 में जे.जे. थॉमसन ने परमाणु में ऋण आवेशित कण इलेक्ट्रॉन तथा धनावेश के वितरण की व्याख्या हेतु एक मॉडल का प्रतिपादन किया जिसे थॉमसन का परमाणु मॉडल कहते हैं |
इस मॉडल के अनुसार परमाणु 10^-10 (10 ke power -10) m त्रिज्या का एक धन आवेशित गोला होता है| धन आवेश संपूर्ण परमाणु में एक समान रूप से वितरित होते हैं तथा ऋण आवेशित इलेक्ट्रॉन उसमें ठीक उसी प्रकार अंतः स्थापित होते हैं जैसे तरबूज में बीज|
थॉमसन के परमाणु मॉडल को तरबूज मॉडल तथा प्लम पुडिंग मॉडल ( plum pudding model)भी कहा जाता है|
 |
| Thomson model image |
थॉमसन के परमाणु मॉडल की कमियां(Thomson ke Parmanu model ki kamiyan) :
1. यह माडल रदरफोर्ड के अल्फा कणों के प्रकीर्णन को नहीं समझा सका|
2. यह मॉडल परमाणु के स्थायित्व को समझाने में असफल रहा|
3. यह मॉडल स्पेक्ट्रमी रेखाओं की व्याख्या करने में असफल रहा |
4. इस मॉडल में परमाणु के नाभिक के बारे में कोई जानकारी नहीं दी गई थी |
थॉमसन के परमाणु मॉडल की इन्हीं कमियों को पूरा करने के लिए अर्नेस्ट रदरफोर्ड ने अल्फा कण प्रकीर्णन प्रयोग के आधार पर अपना एक परमाणु मॉडल प्रस्तुत किया जिसें रदरफोर्ड का परमाणु मॉडल कहा जाता है |
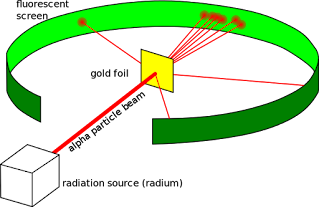
रदरफोर्ड का अल्फा कण प्रकीर्णन प्रयोग ( Rutherford's Alfa particle scattering experiment) :-
रदरफोर्ड ने एक पतली स्वर्ण पत्र के ऊपर अल्फा कणों की बौछार की | इस स्वर्ण पत्र के पीछे जिंक सल्फाइड ( ZnS) का एक पर्दा और एक संसूचक लगा था | जब अल्फा कण जिंक सल्फाइड के परदे से टकराते थे तो एक प्रस्फुर (चमकता फ्लैश) उत्पन्न होती थी|
इस प्रयोग के आधार पर रदरफोर्ड ने निम्न प्रेक्षण प्राप्त किये-
1. अधिकांश अल्फा कण स्वर्ण पत्र को पार कर सीधे निकल जाते हैं |
2. कुछ अल्फा कण अल्प कोण से विक्षेपित होते हैं |
3. बहुत ही कम अल्फा कण( 20000 में से 1) उसी पथ पर वापस लौट आते हैं |
इन्हीं प्रेक्षण के आधार पर रदरफोर्ड इन अपना एक मॉडल प्रस्तुत किया|
 |
| Geiger Marsden experiment |
रदरफोर्ड का परमाणु मॉडल (Rutherford's atomic model) :-
रदरफोर्ड के परमाणु मॉडल के मुख्य अधिग्रहित निम्न है-
1. प्रत्येक परमाणु में एक सुक्ष्म केंद्रीय भाग होता है जिसे परमाणु का नाभिक कहा जाता है इसी नाभिक में परमाणु का कुल द्रव्यमान और धन आवेश केंद्रित रहता है|
2. इलेक्ट्रॉन नाभिक के चारो और वृत्ताकार कक्षाओं में ठीक इस प्रकार परिक्रमा करते हैं जैसे प्रत्येक ग्रह सूर्य के चारों ओर परिक्रमा लगाते हैं|
इसलिए इस मॉडल को सोर मॉडल के नाम से भी जाना जाता है|
3. नाभिक का आकार परमाणु का आकार की तुलना बहुत छोटा होता है इसलिए परमाणु का अधिकतर भाग रिक्त होता है|
4. नाभिक में उपस्थित धन आवेशो की संख्या नाभिक के चारों ओर परिक्रमा करने वाले इलेक्ट्रॉनों की संख्या के बराबर होती है अतः परमाणु विद्युत उदासीन होते हैं |
रदरफोर्ड के परमाणु मॉडल की सीमाएं( Limitations of Rutherford's Atomic Model) :-
रदरफोर्ड का परमाणु मॉडल कुछ अभिधारणाओं को समझाने में असफल रहा जो निम्न है-रदरफोर्ड के अनुसार इलेक्ट्रॉन नाभिक के चारों ओर वृत्ताकार कक्षाओं में चक्कर लगाते हैं| विद्युत चुंबकीय सिद्धांत के अनुसार त्वरित आवेशित कण सतत विद्युत चुंबकीय ऊर्जा को उत्सर्जित करते हैं अतः इलेक्ट्रॉन द्वारा वृत्तीय गति करते समय सतत ऊर्जा उत्सर्जन के कारण उसकी ऊर्जा कम होती जाएगी| जिससे वृत्तीय पथ की त्रिज्या भी कम होती जाएगी और अंततः एक सर्पिल पथ में गति करते हुए इलेक्ट्रॉन नाभिक में गिर जाएगा | लेकिन वास्तविक रूप में ऐसा नहीं होता है | इलेक्ट्रॉन नाभिक के चारो और सतत गति करता है | अतः रदरफोर्ड का परमाणु मॉडल परमाणु के स्थायित्व को समझाने में असफल रहा |
रदरफोर्ड मॉडल के अनुसार इलेक्ट्रॉन सभी संभव त्रिज्या की वृत्ताकार कक्षा में नाभिक के चारों ओर परिक्रमा करता है तथा सतत ऊर्जा स्पेक्ट्रम का उत्सर्जन करता है | लेकिन यह देखा गया है कि सबसे सरल परमाणु अर्थात हाइड्रोजन परमाणु का स्पेक्ट्रम रेखिल होता है सतत नहीं | अतः रदरफोर्ड का परमाणु मॉडल परमाणु के वर्णक्रम की स्पष्ट व्याख्या नहीं कर सका |
Image credit- 1&2 pixabay. Com3 Wikimedia commons
Class 12th Physics notes in hindi medium👇
> स्थिर वैद्युत(electrostatics) objective type question
> धारा विद्युत(current electricity) objective
> गतिमान आवेश और चुंबकत्व objective
>आवेश की परिभाषा , मात्रक और विमीय सूत्र
> आवेश संरक्षण और आवेश का क्वांटीकरण
> विद्युत क्षेत्र, विद्युत क्षेत्र की तीव्रता, विद्युत द्विध्रुव आघूर्ण
> विद्युत फ्लक्स की परिभाषा , मात्रक और विमीय सूत्र
> चुंबकीय फ्लक्स की परिभाषा, मात्रक और विमीय सूत्र
> विद्युत बल रेखाएं और उनके गुण
> विभव और विभवांतर की परिभाषा मात्रक और विमीय सूत्र
> विद्युत धारा की परिभाषा ,मात्रक और विमीय सूत्र
> धारिता की परिभाषा ,मात्रक और विमीय सूत्र
> प्रकाश का परावर्तन और उसके नियम
> प्रकाश का अपवर्तन और उसके नियम
> दर्पण की परिभाषा ,प्रकार और उपयोग
> क्रांतिक कोण की परिभाषा तथा क्रांतिक कोण और अपवर्तनांक में संबंध









Nice content
जवाब देंहटाएंIsse achha knowledge mila
जवाब देंहटाएंIsse achha knowledge mila
जवाब देंहटाएं